

【醫藥網3月31日訊】
2014年,FDA藥物評價和研究中心(CDER)審批通過了41個新藥(Novel New Drugs),包括新藥申報(NDAs)批准的新分子實體(NMEs)和生物製品申報(BLAs)批准的新生物藥,數量是自1996年以來最多的。2014年FDA批准的新藥有幾個特點:治療罕見病的孤兒藥的批准比往年都多;今年批准的一半以上藥物為"優先審查"(Priority Review),比現有的藥物有了改善;FDA突破性認定藥物的批准是去年的3倍,9個突破性療法指定產品獲得批准;另外,還批准了4個新的抗生素。
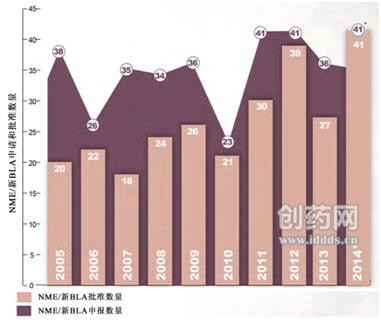
圖1:2005~2014年NME/BLA申請及批准數量(來源:FDA)
圖1中的*- 2014年申報數量包括2014財年歸檔的申報數量+ 2014財年目前待定數量(在60天申報期內);-多次提交(單/多組分)的一個新分子/生物實體只計算一次。
2014年批准的新藥多于過去平均水平(具體藥物見表1),而申請的數量則與過去相比保持相對穩定。2005~2013年,CDER每年歸檔的新藥申請平均為34個,2014年歸檔的申報為41個,與最近10年基本保持一致。2005~2013年,CDER每年批准的新藥申請平均為25個,而2014年批准的新藥為41個,多于同一時期的任何一年(圖1)。
首創新藥(First-in-Class)
2014年CDER審批通過的41種新藥大多數具有顯著的治療效果,對醫療質量和公共健康具有特殊的貢獻。其中,三分之一的新藥(17/41,約41%)被FDA認定為首創新藥,在治療特定適應症時有全新或者特殊的作用機制。
2014年首創新藥見圖2,其中值得一提的有:
l Harvoni-治療特定病人的慢性丙肝;
l Keytruda-用於不能手術切除或者轉移的黑色素瘤;
l Zontivity-用於降低心臟疾病特定病人發生血栓性心血管事件的風險。
 圖2:罕見疾病藥物
圖2:罕見疾病藥物
2014年審批通過的新藥中,大約41%(17/41)用于治療罕見疾病或者"orphan"疾病,這些疾病困擾著20萬的美國人,這些藥物批准的意義主要是罕見疾病治療藥物的匱乏。
2014年罕見疾病藥物見圖3,其中值得一提的有:
l Vimizim——用於治療ⅣA型黏多糖貯積症(半乳糖-6-硫酸酯缺乏引起),是首個獲FDA批准治療該疾病的藥物;
l Impavido——用於治療利什曼病,最初作為抗腫瘤藥物,後發現其有抗寄生蟲的作用;
l Sylvant——白細胞介素6單克隆抗體,治療罕見病多中心型巨大淋巴結增生症(MCD)。
l Cerdelga——-治療Gaucher病;
l Esbriet和Ofev——治療特發性肺纖維化;
l Myalept——治療脂肪代謝障礙繼發的代謝紊亂,是一種重組人甲硫氨瘦蛋白。 圖3:2014年批准的罕見疾病藥物
圖3:2014年批准的罕見疾病藥物

