

還記得風靡全球的冰桶挑戰賽嗎?此活動由美國發起,目的在於讓人們瞭解肌肉萎縮性側索硬化症,喚起全世界對“漸凍人”的關注。其實這只是罕見病中的一種,罕見病種類繁多,大多為遺傳類疾病,發病率較低,治療手段落後,研究罕見病的醫藥企業研發熱情不高。可近幾年孤兒藥的發展有了明顯改變。
以美國FDA和歐盟EMA 2010-2016年批准授權的孤兒藥的數量為例,可以看到近幾年來孤兒藥的批准授權的數量較以往有大幅度提升,此資料還未包括同一藥物增加新適應症又被批准授權的情況。
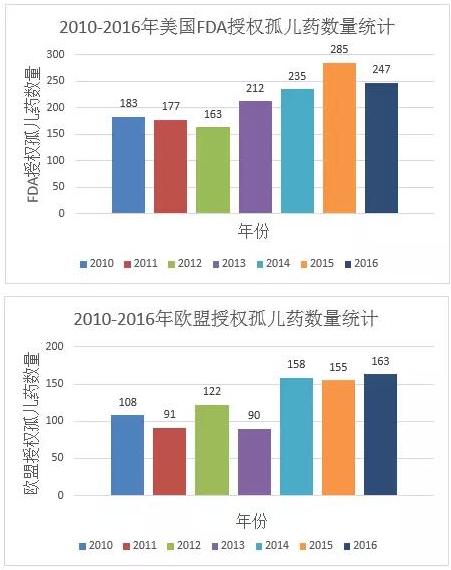
眾所周知,開發新藥從研究階段到申報審核週期較長,前期投入較多,沒有豐厚實力的小公司很難承受,而專注研究孤兒藥這一領域,對於他們而言,確是一個不錯的契機。將從以下三方面來分析近年來孤兒藥研發的火熱。
首先,雖然罕見病的受眾群體不及常見病,但各國政府為此都提出豐厚的優惠措施,以美國FDA、歐盟EMA和日本厚生勞動省(MHLW)為例,美國FDA為支持孤兒藥開發,提出孤兒藥臨床試驗費用的50%可以作為稅收抵免,並可向前延伸3年,向後延伸15年。免除新藥申請費,且相關基金可以提供研究資金資助臨床試驗。對已認定的孤兒藥經美國FDA批准上市後可享有7年的市場獨賣權;授予優先審查,獎勵成功開發兒童罕見病治療產品的企業 。
歐盟EMA提出申請費減免,還有歐盟成員國提供的研究經費支援,授予孤兒藥10年市場獨賣權,兒童孤兒藥可延展至12年;授予集中化審核程序,不必向每個歐盟成員國單獨遞交上市申請。
日本也有包含資金補貼、減少申請費、減稅補貼、開發協助(免費顧問和臨床方案協助)快速審核和市場獨佔期的激勵措施。
其二,如果在某一罕見病的專業領域能夠有所建樹,能很快在此領域有足夠的發言權,它所帶來的市場價值和回報率是無法想像的。龐貝氏症屬於溶小體儲積症(LSDs)。Novazyme 公司創始人[2]約翰克羅利的女兒患有該罕見病,2000 年,為了幫助女兒能夠獲得特效的治療藥物,約翰與奧克拉荷馬大學的教授威廉坎菲爾德一起創立了Novazyme 公司,致力於開發治療龐貝病的藥物。Novazyme 公司的技術平臺很快獲得了業界其他公司的關注,Genzyme 和Genetech 都希望能夠收購Novazyme 公司。2001年8月,Genzyme 公司以1.3億美元完成對這家僅成立2年多的公司的收購。
其三,醫學的發展瞬息萬變,罕見病和常見病並沒有固定的界限,罕見病可能隨著發病人群的增多變成常見病,而隨著研究的不斷深入,一個藥物所對應的適應症也會不斷地擴大,我們以FDA授權藥物為例,美國的Millennium 製藥公司研製的Bortezomib從2011年被授權用於非霍奇金淋巴瘤的治療,在2012和2015年的授權中,又研究發現其對套細胞淋巴瘤和急性淋巴細胞性白血病也有治療效果。無獨有偶,美國西雅圖遺傳公司研製的brentuximab自從2012年被授權,一直致力在淋巴瘤的相關領域,2013、2014和2016年都對此藥物擴大臨床適應症並且又被批准授權。當然,這樣的例子還有很多,都是以血液疾病和腫瘤疾病居多。其實也存在授權的藥物新適應症與老適應症關聯不大,比如一氧化碳普遍認為是有毒氣體,但是美國FDA在2012年批准授權給美國的Hillhurst 生物製藥公司,用於治療鐮狀細胞病;又在2016年批准授權給美國的Proterris公司,用於治療特發性肺纖維化,不同研發團隊的研究成果不同,豐富了藥物的臨床作用,造福患者。
近年來,中國在孤兒藥和罕病產品研發創新方面提供了很多優惠措施,例如:罕見病創新藥的註冊提供單獨排隊,加快審批。建立首個中國國家級罕病診療與保障專家委員會。提出公佈罕病名錄,建立罕病患者登記制度。微芯生物研發的西達苯胺在中國獲批上市了,它其實就是按照孤兒藥來申報的,也是中國首個授權美國等發達國家專利使用的原創新藥。中國目前已有一些醫藥公司進軍孤兒藥領域,相信隨著對罕見病的重視和關注,孤兒藥的發展會更好,造福更多的罕病患者。
(醫藥網)

