

Copyright©生策會.生策中心 本文內容受著作權法保護,如有引用,請註明出處
根據Clinical.gov資料,全球由企業主導開發、登錄的新冠新藥2、3期臨床試驗高達700多個!其中500多個臨床試驗正在各國積極展開收案,國際競爭之烈前所未有!本文彙整美國FDA核准藥證、以及各界關注之口服新藥進展,台灣生技新藥企業的研發投入概況,三個面向綜覽國內外藥物開發競賽的腳步。
■ 全球1項取得FDA藥證核准、5項緊急授權、僅1項口服
2020年5月,吉立德(Gilead)公司的瑞德西韋(Remdesivir)成為第一個獲得美國FDA緊急使用授權(EUA)的新冠肺炎治療藥物。瑞德西韋為RNA聚合酶抑制劑,原開發用於伊波拉病毒治療,在新冠疫情間,陸續完成重症4891人、中症1113人的3期臨床試驗,在同年10月取得FDA正式核准,可用於成人或12歲以上的住院患者。至於體重較輕或年齡較小的兒童,則仍依EUA規範使用。
現階段取得EUA的企業多為一線國際大藥廠,包括禮來(Eli Lilly)取得兩張EUA(Baricitinib以及Bamlanivimab and Etesevimab);GSK則與Vir Biotechnology合作開發Sotrovimab中和抗體、抑制病毒進入細胞;生物藥大廠再生元(Regeneron)則以包含兩種單株抗體(Casirivimab and Imdevimab)的抗體雞尾酒藥REGEN-COV獲緊急授權;最新的一項EUA則由羅氏旗下的基因泰克(Genentech)研發的 IL-6單株抗體皮下注射取得,主要機轉係透過抑制IL-6、避免免疫風暴(Cytokine Storm)造成重症惡化。
目前FDA核准與緊急授權的藥物中,多為臨床上已使用的老藥或研發中的抗病毒藥物、及免疫調節劑與抗體藥物等。在劑型上則多為注射型態,僅1項Baricitinib為口服劑型。
表一. 美國FDA核准與緊急授權使用之COVID-19治療藥物一覽表
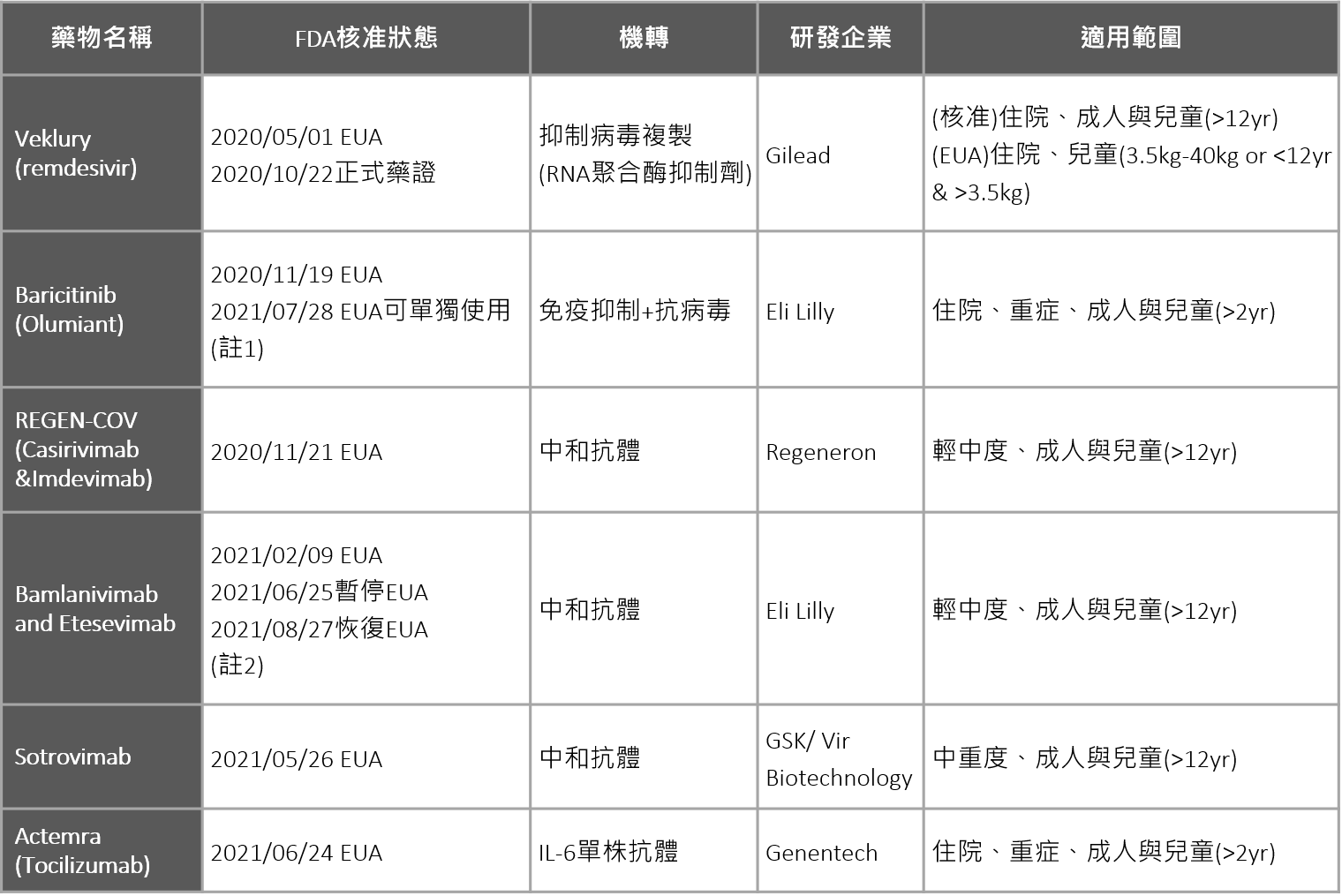
資料來源:美國FDA、各公司官網,生策會、生策中心研究彙整製表
(註1) 2020/11/19 Baricitinib首次取得之緊急使用授權需與remdesivir合併使用,用於治療住院重症患者;而後FDA於2021/07/28公告修訂,給予Baricitinib單獨使用之緊急使用授權。
(註2) 2021/02/09 FDA給予Bamlanivimab和Etesevimab合併使用於治療輕、中症之患者之緊急使用授權;後因Bamlanivimab和Etesevimab對變種病毒活性不佳,於2021/06/25暫停;2021/08/27重新修訂可使用於感染變種病毒比例小於5%的地區。
|
(表一)於2022/04/20更新,請參閱:【2022更新】美國FDA核准與緊急授權使用之COVID-19治療或預防藥物 |
■ 口服新藥研發領先群:禮來、輝瑞、羅氏、默沙東等進入最後一哩路
檢視現階段全球由企業發起的、以新冠肺炎為適應症的三期臨床試驗超過150項,多數為針劑劑型,僅少數為口服藥物。而新冠新藥研發的切入方向則有「治療住院患者避免重症惡化」、「治療重症引起的症狀」、「治療染疫患者避免住院與重症」,以及「針對病毒暴露後的預防」等。
以臨床試驗進度觀察,口服新藥領先群仍為國際大廠,進度最快的是已取得EUA的禮來(Eli Lilly)-Baricitinib,該藥物原是治療類風濕關節炎的免疫調節藥物,今年6月甫完成1585人的臨床三期試驗,主要針對住院之成人患者治療、避免重症惡化。
而攜手BNT成功開發疫苗的輝瑞、和過去成功開發克流感的羅氏藥廠在新冠藥物的布局亦不缺席!輝瑞自行開發的PF-07321332、羅氏與Atea公司授權合作的AT-527,分別為蛋白酶抑制劑以及RNA聚合酶抑制劑,主要機轉都在抑制病毒複製,開發目的都是鎖定感染後的住院預防、重症預防,所以可用於非住院患者之治療。今年4月輝瑞CEO -Albert Bourla表示,PF-07321332目標2021年底取證,有機會成為第一個可居家服用的藥物(home-cure pill) ;至於羅氏的AT-527,則於今年度4月啟動第一例收案,預計將納1386人、8月完成試驗收案。特別值得一提的是,雖然AT-527目前的臨床試驗仍以染疫患者為收案對象,但Atea公司評估認為,由健康受試者的結果顯示,AT-527的活性代謝物能在肺部內襯液(lining fluid)中達到足夠的濃度,而這正是新冠病毒複製的地方,因此有潛力可用於病毒暴露後的預防,未來相關新試驗的開展確實值得關注。
同樣亦針對非住院、早期輕度與中度的患者、由默沙東藥廠與Ridgeback公司合作開發的molnupiravir,該藥物是核糖核苷的類似物,機轉係在新冠病毒複製時嵌入基因造成突變、阻斷病毒複製,今年6月並獲美國政府簽訂採購協議,一旦取得EUA即可生效。
中國開拓藥業(Kintor Pharmaceutical)研發中用於癌症治療的雄性激素受體拮抗劑Proxalutamide,則因能夠降低ACE2和TMPRSS2的表現,從而抑制病毒感染宿主細胞、阻斷病毒複製,在巴西單一國家進行588人的3期臨床試驗結果顯示能將重症患者的死亡風險降低92%,目前亦開展全球多國多中心的大規模臨床試驗。
最後是原用於流感、本為富士軟片集團1998年開發的Favipiravir,由於原始化合物專利在許多國家已到期,全球包括印度、俄羅斯、中國等地已有學名藥廠分別啟動3期臨床試驗,期搶市場先機。
表二. 晚期臨床階段之口服COVID-19治療藥物
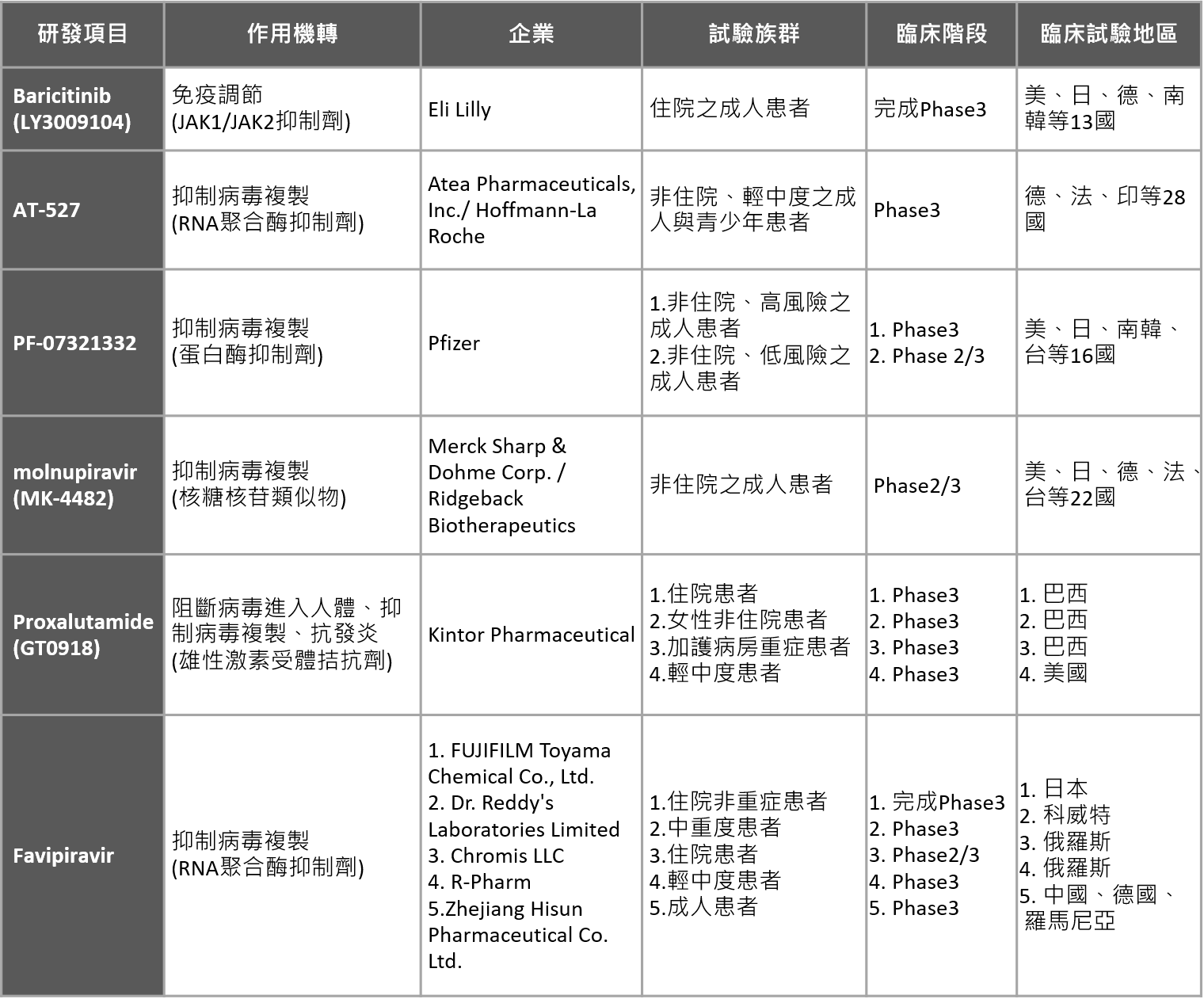
資料來源:美國Clinicaltrials.gov網站、各公司官網、國際通訊社新聞,生策會、生策中心研究彙整製表
■ 9家台灣企業投入新冠新藥研發,多元藥物開發策略切入不同目標市場
根據國內企業公開資料,目前已宣布啟動新冠新藥研發之企業包括藥華、生華科、逸達、國鼎、心悅生醫、合一、昱厚、台微體以及中裕,藥物機轉以免疫調節、抑制病毒與抗發炎為主流,鎖定輕、中重症治療,以及重症引發之呼吸窘迫症狀治療,劑型以口服4項為最多、經鼻吸收3項、針劑2項,研發多元切入不同的藥物目標市場。
資料來源:美國Clinicaltrials.gov網站、台灣藥物臨床試驗資訊網、各公司官網、國際通訊社新聞,生策會、生策中心研究彙整

