

Copyright©生策會.生策中心 本文內容受著作權法保護,如有引用,請註明出處
面對COVID-19前無所見的挑戰,疫苗研發力與生產力決定了疫情戰役下半場的走向,是全球遏止疫情失控、走回正常生活、經濟復甦的關鍵!有鑑疫苗不僅是戰備物資、疫苗產業更是國安產業!唯有從全球產業競賽與各國布局去客觀了解台灣在國際競爭的位置、方得進一步思考中長期產業發展策略與推動方針。
據此,生策會、生策中心針對「全球COVID-19疫苗緊急授權使用與核准上市情況」、「全球疫苗研發進度與技術平台採用情況」、「全球疫苗開發領先國家分析」、「成功開發新冠疫苗之企業與機構樣貌」以及「全球新冠疫苗主要生產製造國家」等五大面向進行研究彙整,期提供產官學研參酌,掌握各國疫苗競賽動向、俾利各界客觀探討台灣機會、市場與發展策略。
從2020年1月疫情爆發以來,短短1年半,全球已有20個疫苗通過緊急授權使用(Emergency Use Authorization, EUA),包括中國7個、俄國4個、美國3個(其中1項為美德合作)、伊朗2個(其中1項為與古巴合作)、另英國、印度、哈薩克、古巴各1個。
然而,截至6月底,納入世界衛生組織(WHO)緊急使用清單(Emergency Use Listing, EUL)則僅有6項,分別為美德合作的Pfizer–BioNTech、美國J&J/Janssen及Moderna,還有英國Oxford–AstraZeneca、及中國Sinopharm-BBIBP、CoronaVac(EUL共列8項,但其中3項包括AZ/SKBio、AZ/EU及Covishield皆為AstraZeneca疫苗,故本文只列計6項);此外,納入歐盟疫苗護照承認者則僅有4項,為Pfizer–BioNTech(Comirnaty)、Oxford–AstraZeneca(Vaxzevria)、J&J/Janssen、Moderna(Spikevax)。
表一. 全球COVID-19疫苗獲緊急授權使用一覽表
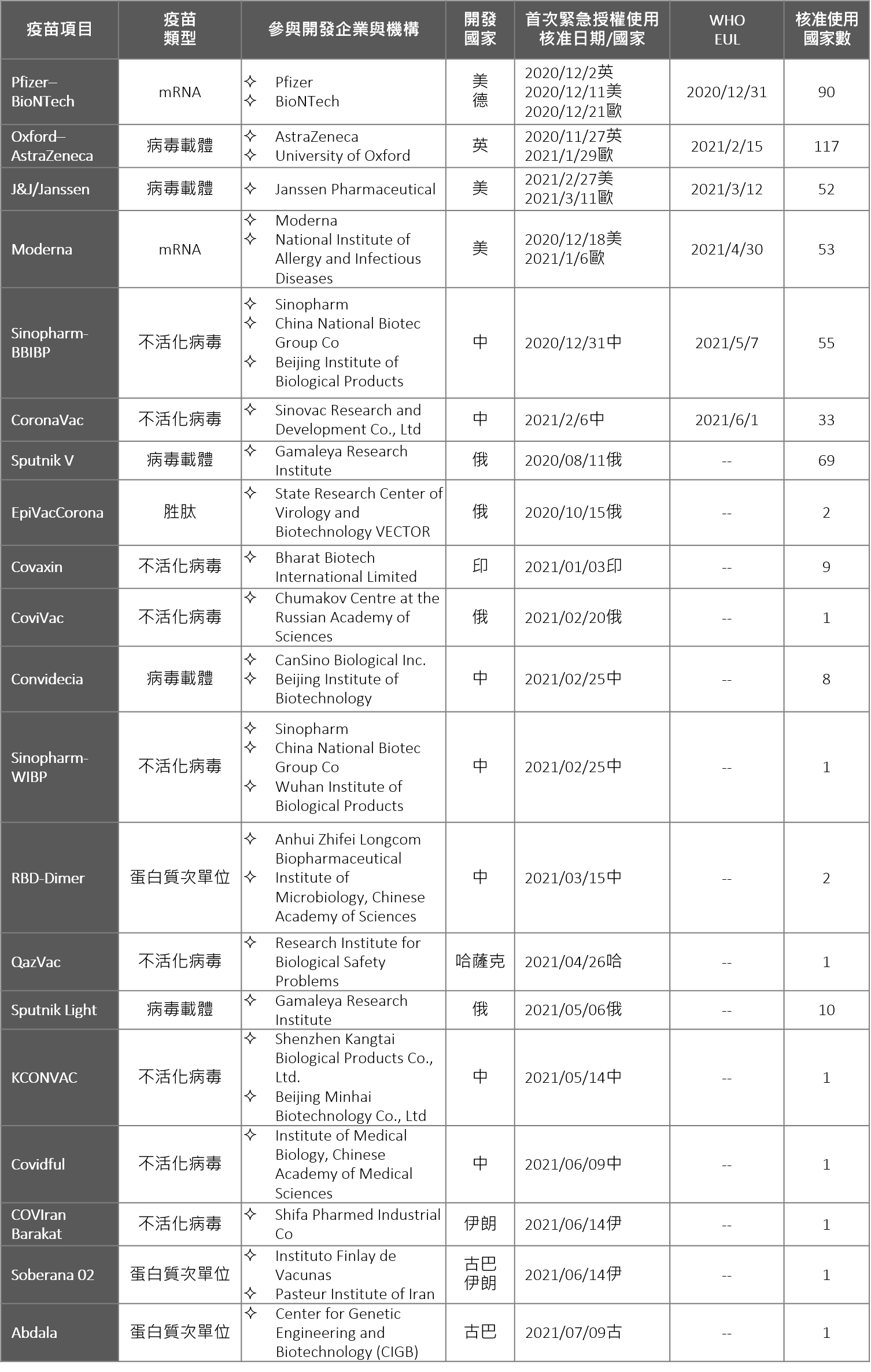
*註1.古巴自5/14日開始大量施打自行開發之Soberana 02、Abdala疫苗,截至7/9,Abdala疫苗已獲緊急使用授權,Soberana 02疫苗仍在監管單位CECMED的審查中。
*註2.獲緊急授權使用之疫苗列表將滾動式更新。
資料來源:WHO、各國衛生主管機關公告、國際通訊社新聞,生策會、生策中心研究彙整製表
根據WHO「COVID-19 vaccine tracker and landscape」截至2021/6/30資料顯示,現階段全球疫苗開發項目共287項,其中已進入臨床試驗階段者共有97項,包括25項3期及2/3臨床試驗、37項臨床2期及1/2期、35項為臨床1期試驗;另外184項則仍在前臨床試驗階段。
在疫苗技術平台的採用上,獲WHO EUL的6種疫苗中,使用核酸、病毒載體與全病毒技術平台者各有2項;如以研發總數進行分析,則以蛋白質次單位疫苗佔最大比例達36.2%,其中9項進展至第3、2/3臨床試驗,包括美國Novavax公司的NVX-CoV2373以及賽諾菲/GSK開發的VAT00002;核酸次之23%、其中包括德國CureVac公司;病毒載體21.3%、類病毒佔8%,全病毒佔10.1%。
劑型方面,超過九成為針劑,近期各國亦開始投入吸入或口服劑型,如中國康希諾將已核准之注射型Convidecia疫苗改為鼻噴劑型,已申請緊急使用中,另中國萬泰公司亦已完成鼻噴劑型疫苗的臨床2期試驗。投入口服疫苗開發的則有美國Vaxart公司、加拿大Symvivo公司等,皆在臨床1期研發階段。
表二. 全球疫苗研發各階段分布與技術平台應用概況
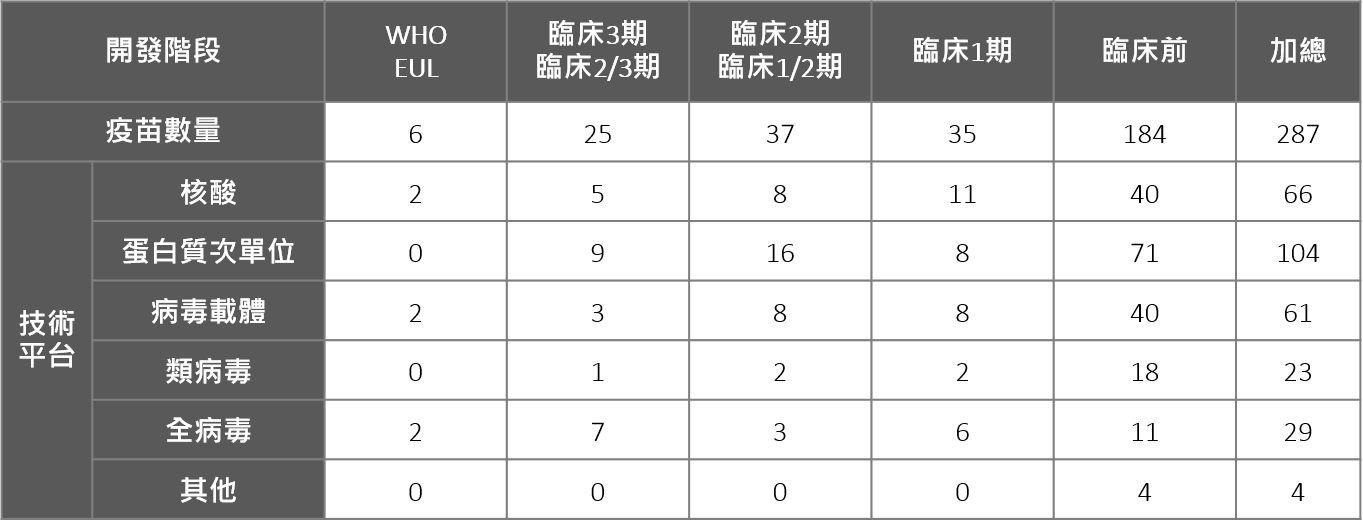
*註1.由於前述資料係為WHO R&D Blueprint團隊收集整理,亦開放各國機構自行登錄,故可能有所疏漏、或臨床各階段資訊與實際進度有部分時間差異、或部分項目實際已停止開發等狀況;如中硏院最近開發的單醣S蛋白質次單位廣效疫苗及mRNA疫苗、國衛院與安特羅合作開發之DNA疫苗皆屬臨床前階段,另俄羅斯開發之Sputnik Light、CoviVac等亦未列在此列表;另包括高端MVC-COV1901、聯亞集團UB-612(Vaxxinity)、以及國光生技AdimrSC-2f等研發項目則都有收錄。
*註2.本表臨床3期與2/3期疫苗數量包括11項已取得部分國家核准緊急使用、但未列入WHO EUL之項目:俄羅斯Sputnik V (Gamaleya)、EpiVacCorona (FBRI)、印度Covaxin (Bharat Biotech)、中國Convidecia (康希諾)、RBD-Dimer (智飛龍科馬)、Covidful(中國醫學科學院)、Sinopharm-WIBP(國藥)、KCONVAC(康泰)、哈薩克QazCovid-in® (Kazakhstan RIBSP)、伊朗COVIran Barekat (Shifa)、古巴Abdala(CIGB)。
*註3.此表疫苗技術平台中所稱之核酸技術平台包括DNA與RNA疫苗;單白質次單位技術平台亦包括胜肽疫苗;全病毒技術平台包括不活化疫苗與減毒疫苗;其他技術平台包括細菌載體、細胞疫苗。
圖一. 全球疫苗研發技術平台種類與研發進展分布
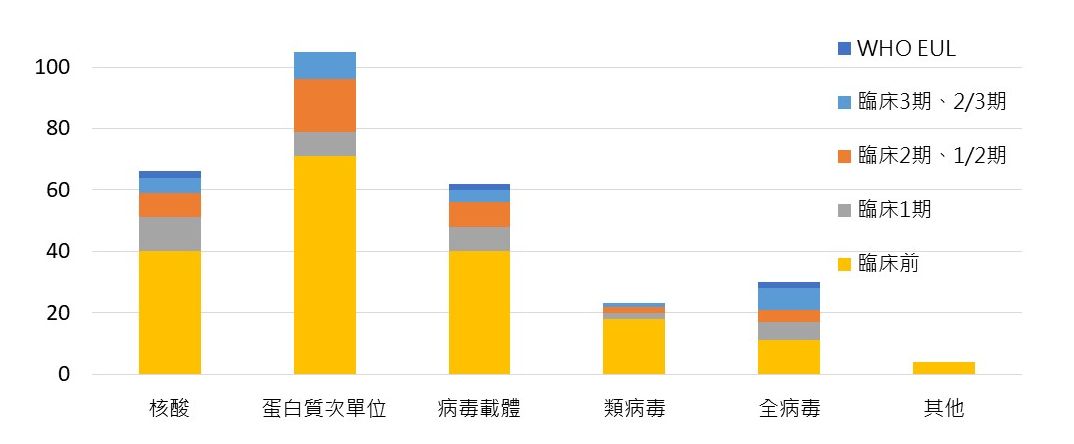
資料來源:WHO,生策會、生策中心研究彙整製表
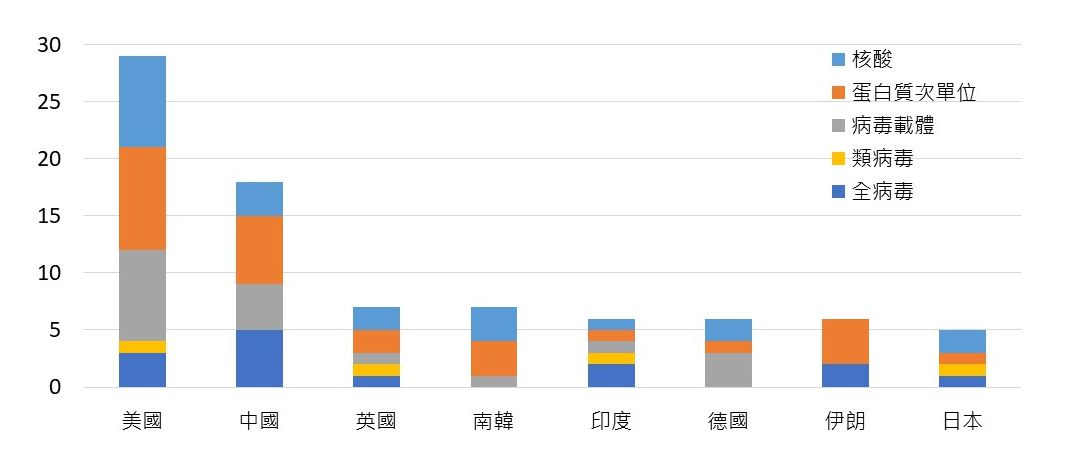
根據WHO資料,全球共有25個國家開發之疫苗已進入臨床階段,如以取得緊急授權使用、以及疫苗進入臨床試驗階段總數評估並進行排序,則全球疫苗領先群以美國為首,開發臨床階段的疫苗29項,其中有3項已取得WHO EUL、3項3期臨床試驗,其中Pfizer-BioNTech、Moderna並已向FDA提出正式藥證(BLA)申請。目前美國境內疫苗研發技術平台以核酸(DNA&RNA)、病毒載體、蛋白質次單位疫苗為主;主要研發企業包括Moderna、Pfizer、Novavax、J&J在開發階段皆獲美國衛生及公共服務部(Department of Health and Human Services, HHS)「神速行動(Operation Warp Speed)」高額補助研發、製造與採購,分別補助41億美元、19.5億元、16億元與14.5億元。
在美國之後,中國以總數18項位居第2,中國所開發的18項疫苗中、7項已可在本國或外國使用,其中並有2項納入WHO EUL。中國疫苗研發採用之技術平台則以全病毒、蛋白質次單位、病毒載體為主流;接續則為英國與南韓,皆有7項,然相較英國已經有1項取得EUL、3項進入臨床試驗3、2/3期,南韓的7項疫苗仍在1、2期早期開發階段;此外,德國、印度、伊朗疫苗研發總數各有6項,其中德國除已取得1項WHO EUL外,更有2項進入晚期臨床試驗階段,應用之技術平台則以核酸與病毒載體為主流;另,日本亦有5項疫苗進入臨床開發階段、其中2項(核酸與類病毒)已進入3期臨床試驗。
圖二. 全球25國已進入臨床階段之疫苗開發數量與開發階段分布
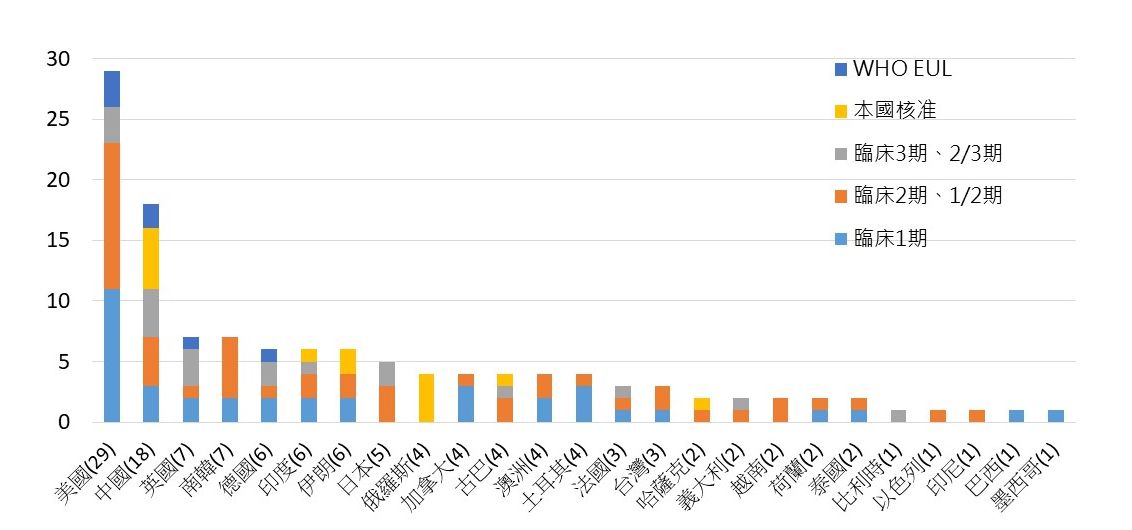
資料來源:WHO,生策會、生策中心研究彙整製表
*註1.如疫苗由不同國家之企業與機構合作開發,則開發者各所屬國家皆列計一次
*註2.台灣疫苗研發之項目包括高端MVC-COV1901(2期)、聯亞UB-612(2期)、以及國光生技AdimrSC-2f(1期)
圖三. 疫苗開發領先國家採用之技術平台
資料來源:WHO,生策會、生策中心研究彙整製表
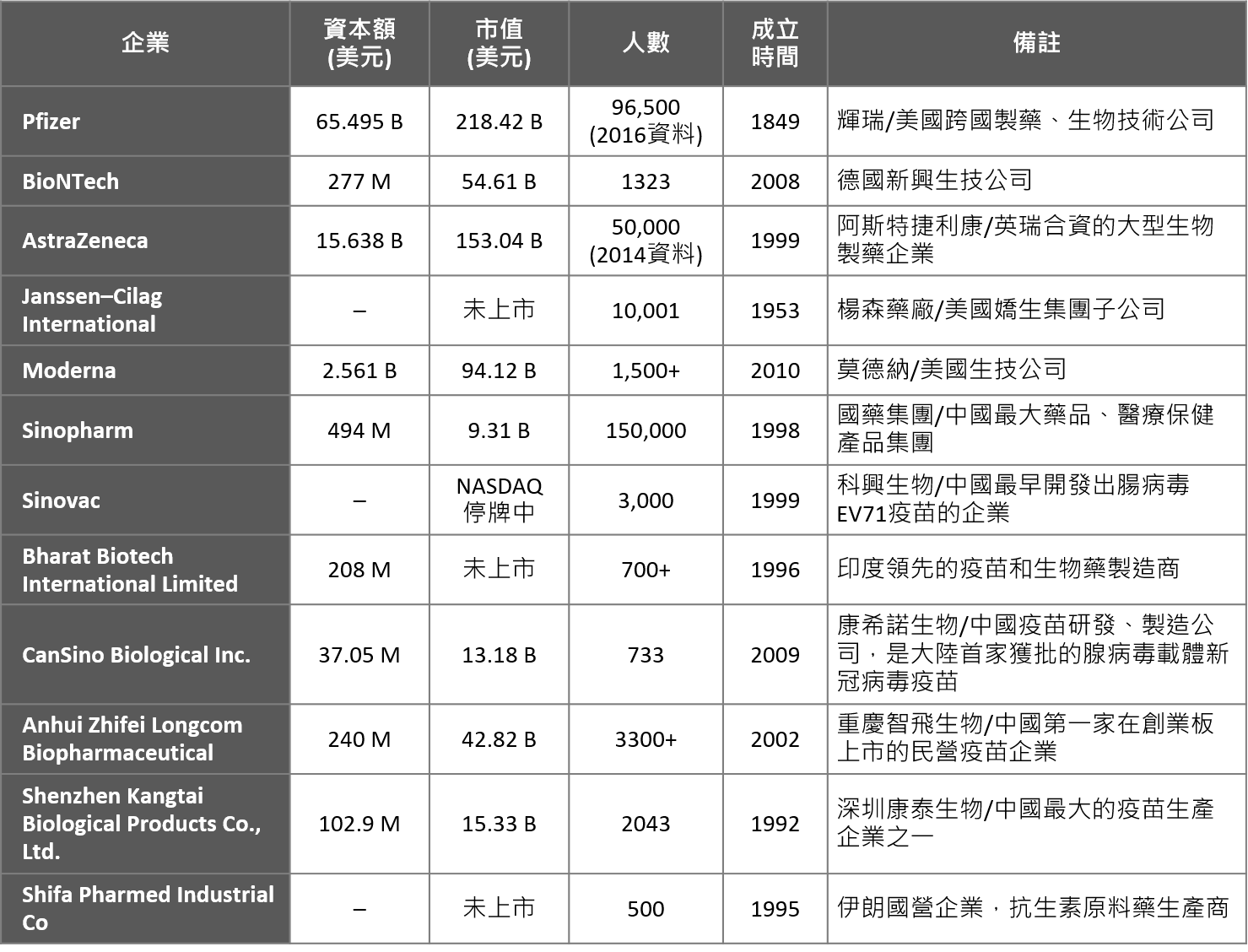
以目前全球20個取得緊急授權使用之疫苗進行分析,主導、參與疫苗成功開發之企業與機構共有23家,其中12家為企業、12家為大學院校及研究機構。
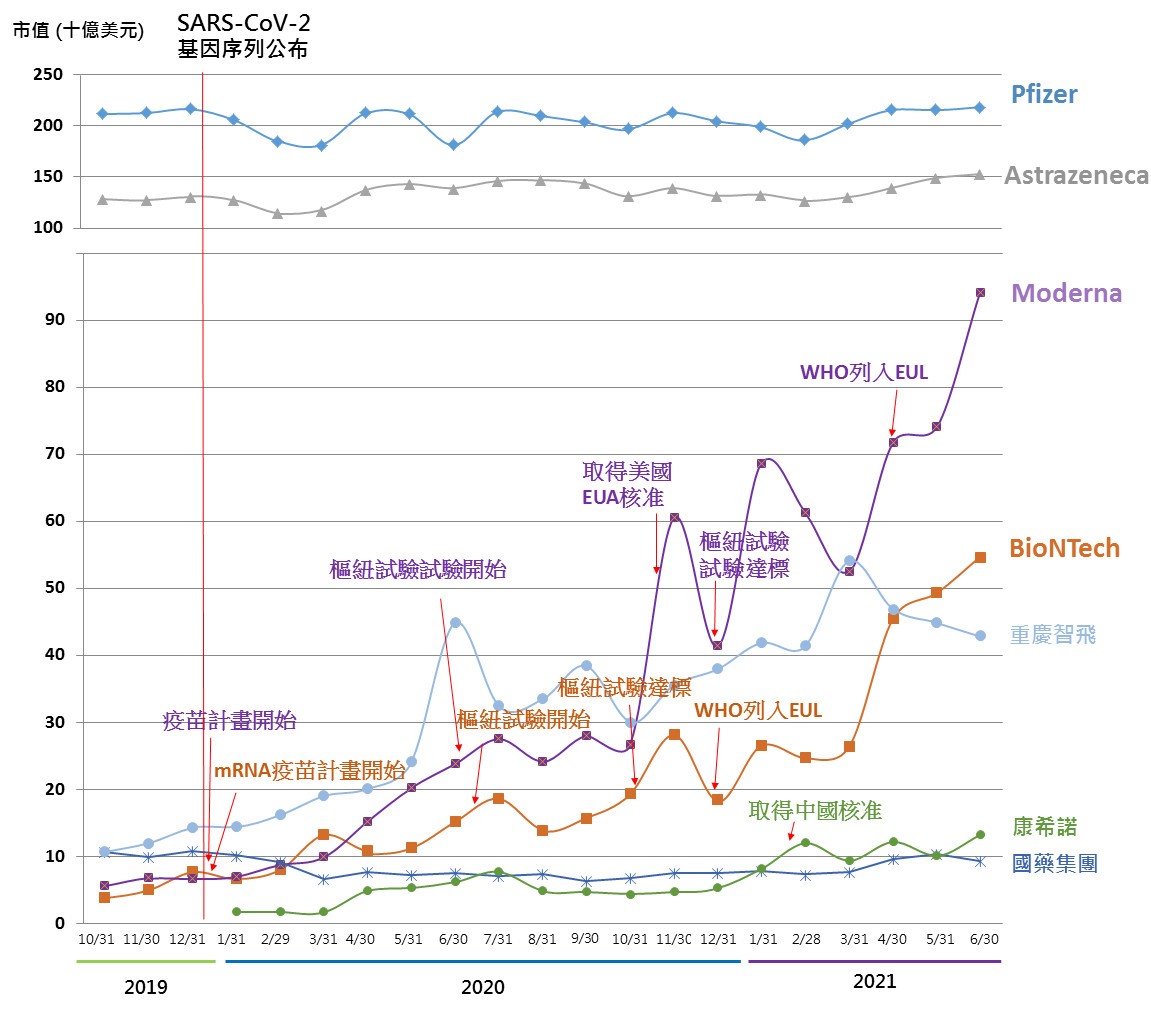
在企業部分,資本規模落於1.03億美元至655億美元間,最小為深圳康泰生物(Shenzhen Kangtai Biological)、最大為輝瑞藥廠(Pfizer);企業規模人數則落於500人至96,500人;成立時間最短為美國新興生技公司Moderna(2010年);其中上市企業共8家、非上市企業(含停牌者)4家,上市企業市值部分,最大為輝瑞藥廠(Pfizer)的2184億美元、最小為國藥集團約93.1億美元;而在疫苗研發開始至上市後迄今市值變化最大者則為Moderna、BioNTech以及中國康希諾,市值自2019/10/31至2021/6/30期間增長則分別達16倍、13.4倍、6.9倍;其中亦有市值衰退者,如中國國藥集團。
表三. 全球主導、參與疫苗成功開發之企業一覽
資料來源:各企業公開資料、各國交易所公開資訊、國際財經網站、WHO,生策會、生策中心研究彙整製表;企業市值係以2021/6/30為計算基準日
*註:如主導參與疫苗開發之企業為同一集團或母子公司者,則僅列計1間。如China National Biotec Group Co(中國生物技術公司)、Beijing Institute of Biological Products(北京生物製品研究所公司)、Wuhan Institute of Biological Products(武漢生物製品研究所公司)皆隸屬Sinopharm(國藥集團);Beijing Minhai Biotechnology Co., Ltd(北京民海生物)則為Shenzhen Kangtai Biological Products Co., Ltd.(深圳康泰生物)子公司。
圖四. 全球主導、參與疫苗成功開發之已上市企業市值趨勢變化
資料來源:各企業與各國交易所公開資料,生策會、生策中心研究彙整製表
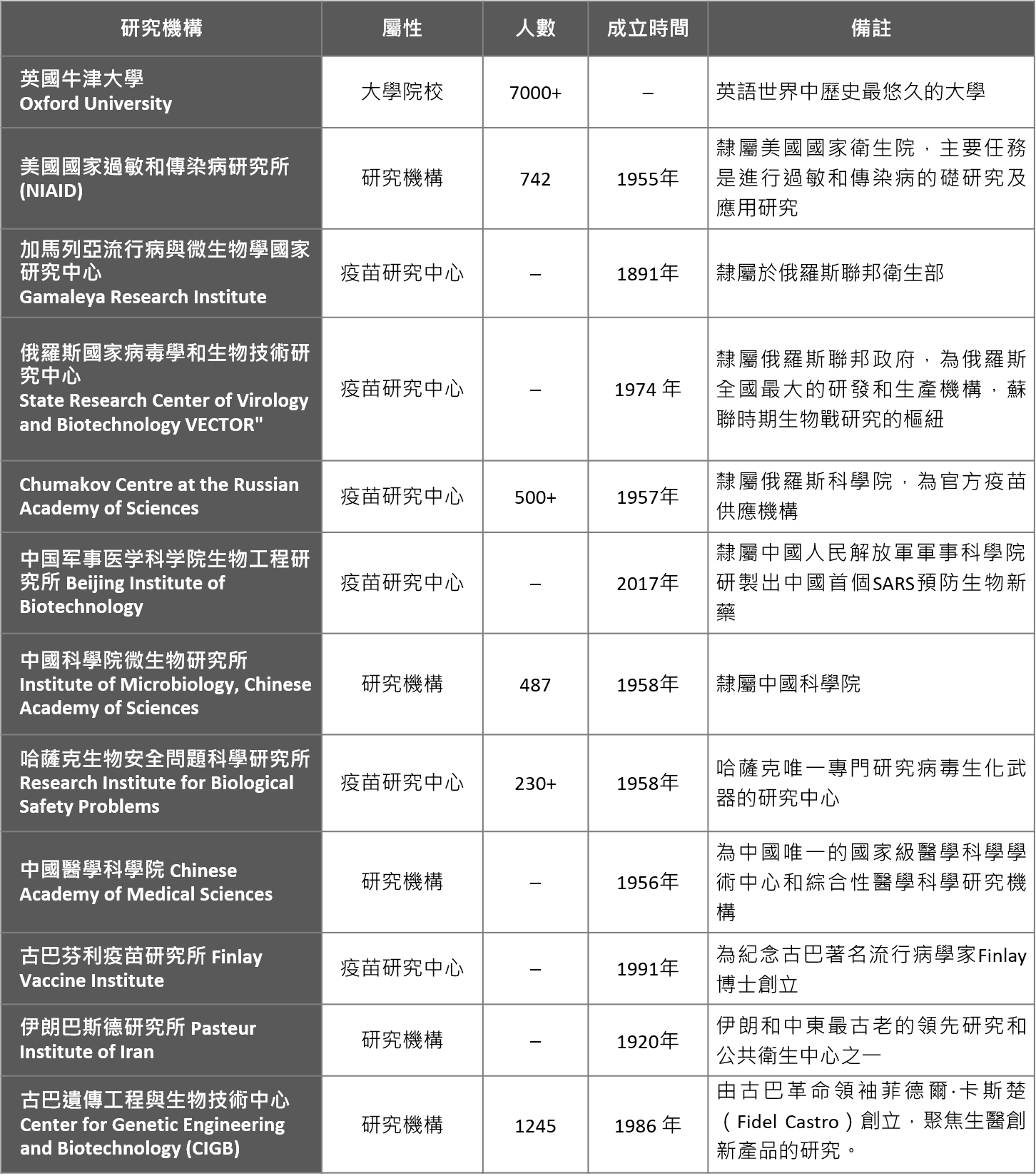
在研究機構部分,僅英國牛津大學(Oxford University)1家為大學院校,其他11家皆為隸屬政府部門之研究機構。原即為疫苗研究中心有6家,分別為中國軍事醫學科學院生物工程研究所、俄羅斯加馬列亞流行病與微生物學國家研究中心(Gamaleya Research Institute)、俄羅斯國家病毒學和生物技術研究中心(VECTOR)以及Chumakov Centre at the Russian Academy of Sciences、哈薩克生物安全問題科學研究所(Research Institute for Biological Safety Problems)和古巴芬利疫苗研究所(Finlay Vaccine Institute)。
表四. 全球主導、參與疫苗成功開發之研究機構一覽
資料來源:WHO、各研究機構公開資料、國際通訊社新聞,生策會、生策中心研究彙整製表
為了解全球新冠疫苗主要生產製造國家分布,本文以供應全球主流、亦即WHO EUL所列之6種疫苗進行分析。目前全球負責此6種疫苗生產之製造公司共約44家,坐落美國最多,共10家公司;其次德國5家、日本4家,中國、比利時與荷蘭各3家。
疫苗產製可分為疫苗原液(Drug Substance)與成品(Drug Product)製造兩大階段,可於不同藥廠分階段完成,一般而言,疫苗原液的技術較為複雜、競爭門檻高,其中又以mRNA疫苗生產製造門檻最高,製程包括提取病毒DNA並送入微生物、微生物發酵、DNA純化、DNA轉錄、mRNA純化、脂質奈米顆粒(Lipid-Nano Particle)包覆、等主要步驟。總體而言,原液生產多掌握在原開發國家,包括美國有6家、德國有4家、中國有3家。此外,全球有能力生產高技術門檻mRNA疫苗的國家則僅有德國、美國、瑞士。
表五. WHO EUL 6種疫苗全球製造廠一覽
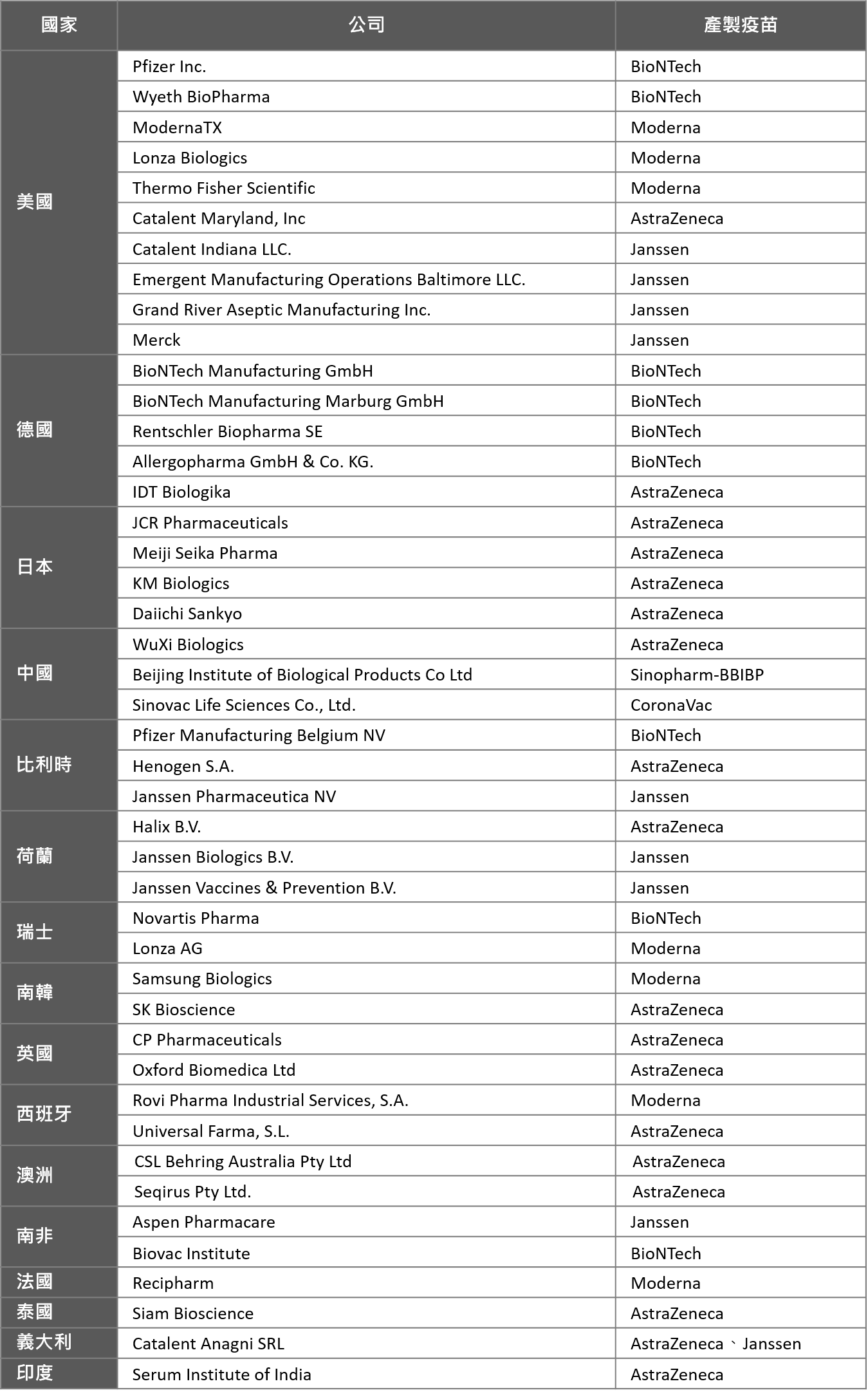
*註1.Pfizer於美國境內製造廠包括位於Kalamazoo, MI、Andover, MA, Chesterfield, MO, Groton, CT和McPherson, KS.等5處,各廠參與不同階段疫苗產製。
*註2.囿於各疫苗生產製造資訊查閱未能窮盡,列表將依最新資料進行滾動式更新,如有闕漏,敬請惠知。
資料來源:各企業公開資訊、EMA、WHO、生策會、生策中心研究彙整製表
圖五. WHO EUL 6種疫苗之原液產製公司與所在國家分布
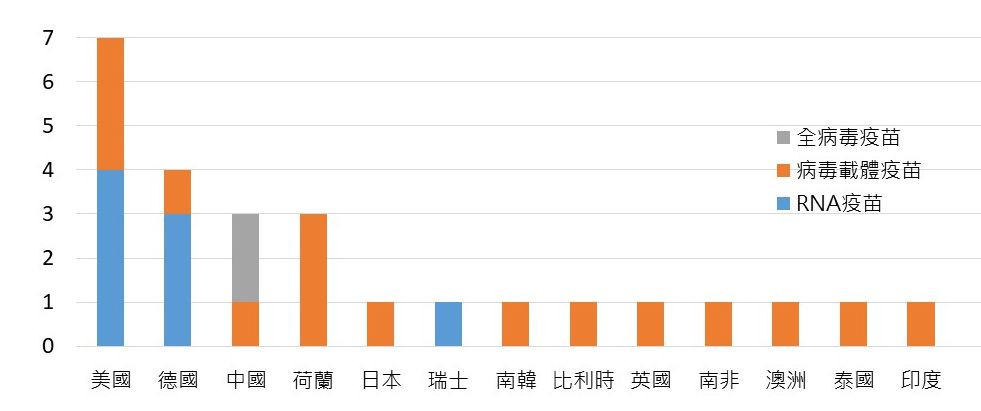
資料來源:各企業公開資訊、EMA、WHO、國際通訊社新聞,生策會、生策中心研究彙整製表

