
本網站中所有資料(包括圖檔及文字檔),著作權皆屬本會所有(除另有註明者,或本會網站連結至外部之網站除外),如有引用,請確實註明出處來源。<完整資訊>
© 2024 Institute for Biotechnology and Medicine Industry (IBMI) All rights reserved.
地址:115 台北市南港區忠孝東路七段508號9樓
電話:(02)2655-8168
傳真:(02)2655-7978


2021-09-16 本會發表「COVID-19新藥研發全球競賽!國內外企業研發綜覽」產業監測報告,持續滾動式彙整「美國FDA核准與緊急授權使用之COVID-19治療藥物一覽表」(2022-04-20更新)如下:
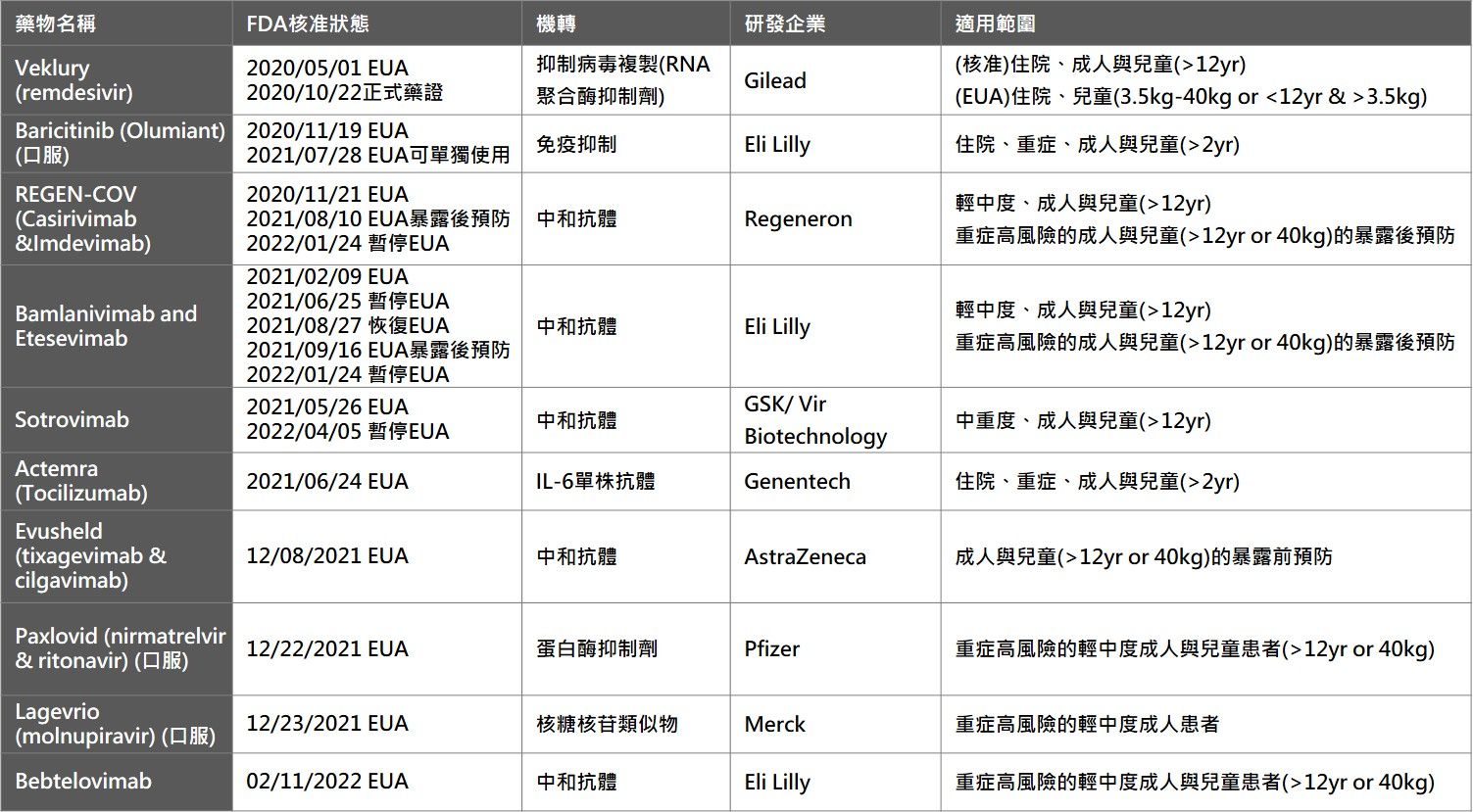
資料來源:美國FDA、各公司官網,生策會、生策中心研究彙整製表
(註1) 2020/11/19 Baricitinib首次取得之緊急使用授權需與remdesivir合併使用,用於治療住院重症患者;而後FDA於2021/07/28公告修訂,給予Baricitinib單獨使用之緊急使用授權。
(註2) 2021/02/09 FDA給予Bamlanivimab和Etesevimab合併使用於治療輕、中症之患者之緊急使用授權;後因Bamlanivimab和Etesevimab對變種病毒活性不佳,於2021/06/25暫停;2021/08/27重新修訂可使用於感染變種病毒比例小於5%的地區。

