

全球新冠疫苗需求殷切,除莫德納(Moderna)、輝瑞報佳音,台灣也積極加大鼓勵國產疫苗發展,國光、高端、聯亞生技三家的人體一期臨床試驗收案順利,預計今年底至明年初進入二期臨床試驗,力拚明年中問世,加入國際賽局。
美國藥廠Moderna日前公布其第三期人體臨床試驗期中分析數據,顯示疫苗保護力達94.5%,超越輝瑞的90%,已規劃向美國FDA申請緊急使用授權,預計今年底前供應美國約2,000萬劑疫苗,明年將全球產能擴大至5億至10億劑。Moderna並於8月和美國政府達成1億劑疫苗供應協議,加上4億劑疫苗的額外購買權,並已在北美、中東和全球其他地區達成多項預採購協議,將是第一波疫苗上市的大贏家。
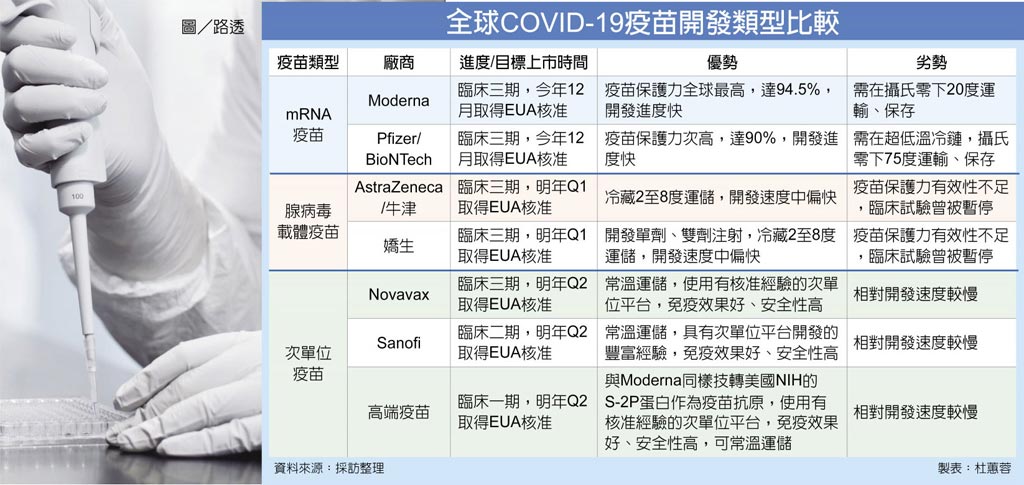
初步統計,全球疫苗開發競賽,以Moderna、輝瑞/BNT的mRNA疫苗開發速度最快,其次阿斯特捷利康與嬌生的腺病毒疫苗,而賽諾菲、GSK和高端以次單位疫苗開發為主,2021年都將分食新冠疫苗大餅。
專家指出,無論是Moderna或是輝瑞生產的mRNA疫苗,未來要在全球展開大規模施打,將面臨超低溫運輸、儲藏的困難。相比mRNA疫苗,腺病毒疫苗僅需要一般冷藏條件(攝氏2~8度),不過因腺病毒平台的先天限制,人體內免疫系統有可能把作為疫苗載體的腺病毒清除,無法引發足夠的免疫反應,有保護力較弱的劣勢。
至於次單位平台開發疫苗,不僅可常溫運輸、儲放,且刺激免疫效果良好、安全性高,但相對開發速度較前二種平台慢,利用此成熟技術開發疫苗的廠商包括有美國Novavax、法國賽諾菲,及台灣的國光、高端、聯亞生技。國光現完成近70位受試者的兩針施打,順利的話,11月底前中就會向主管機關申請二期臨床試驗。聯亞生技與中國醫大合作的一期臨床試驗,月底前應可收案完畢,年底前完成兩針劑的施打,2021年初申請進入二期試驗。
高端與Moderna疫苗同樣來自美國國衛院,都是由Graham博士實驗室依據冠狀病毒所開發的基因重組全長S-2P蛋白抗原,能夠產生優異的免疫反應,高端一期臨床試驗收案已近尾聲,將拚年底取得第二期人體試驗核准,有機會在明年第二季取得國內EUA許可,提供防疫所需。
(工商時報 記者杜蕙蓉)

