

美國FDA宣佈,核准Blueprint Medicines公司開發的Ayvakit(avapritinib)上市,用於治療無法切除或轉移性胃腸道間質瘤(GIST)成人患者。這些患者攜帶PDGFA外顯子(exon)18突變,其中包括攜帶PDGFRA D842V突變的患者,這是最常見的外顯子18突變。Blueprint公司的新聞稿指出,這是首款獲准治療具有特定基因組特徵GIST患者的精准療法。
GIST是一種由基因突變驅動的胃腸道肉瘤,源於胃腸道壁中的特殊神經細胞。大約6%的新確診患者攜帶PDGFA外顯子18突變。最常見的突變為D842V突變,導致患者對所有其它獲准療法產生抗性。
Ayvakit(avapritinib)是一款強力的高特異性KIT和PDGFRA突變激酶抑制劑。Ayvakit已經表現出抑制與GIST相關的廣泛KIT和PDGFRA突變體的效力。這款新藥曾經獲得FDA授予的突破性療法認定、快速通道資格、孤兒藥資格和優先審查資格。
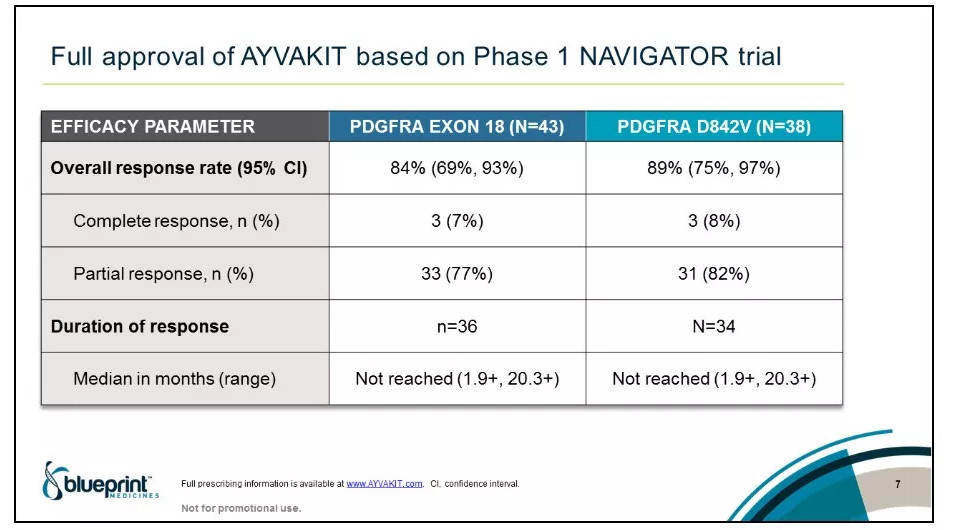
FDA的核准是基於名為NAVIGATOR的1期臨床試驗的療效結果,以及多項臨床試驗的安全性結果。在攜帶PDGFRA外顯子18突變的GIST患者中,Ayvakit達到84%的總緩解率(95 CI: 69%,93%),7%的患者達到完全緩解,患者的中位緩解持續時間(DOR)尚未達到。
FDA腫瘤卓越中心主任Richard Pazdur博士提及:“今天Ayvakit的核准為攜帶PDGFRA外顯子18突變的GIST患者帶來了新的治療選擇,這一患者群之前的治療選擇非常有限。”
Blueprint公司表示,對Ayvakit作為4線療法治療GIST的新藥申請的審查仍在進行中,目前該申請的PDUFA日為今年2月14日。FDA可能將PDUFA日延期3個月,讓Blueprint公司遞交Ayvakit在3期臨床試驗VOYAGER中獲得的Topline Data。這一臨床試驗比較Ayvakit與regorafenib作為3線或4線療法治療GIST患者的效果。
(生策會編譯)

