

來源:生策會編譯
2021迄今,FDA已核准一些備受矚目的新藥,而新冠疫情並未阻擋製藥公司持續推進新藥上市的決心。
Biogen (百健) 頗受爭議的阿茲海默症新藥Aduhelm被加速核准即是一例。Amgen (安進) 的新藥Lumakras也獲准,這是第一款用於治療過去認為無藥可治、由KRAS基因突變引致的肺癌藥物。
新藥競爭仍然如火如荼進行中。根據Evaluate Pharma資訊顯示,FDA將在2021年結束前核准四款重磅新藥,背後的製造商是Argenx、UCB、輝瑞和羅氏等公司。Evaluate預計到2026年,這些藥物銷售額大約落在71億美元。
Evaluate的年中報告指出另一個重磅新藥是Ascendis Pharma的長效生長激素lonapegsomatropin-tcgd。該藥物現在被稱為Skytrofa,預計到2026銷售業績達15億美元。
對於其餘的新藥競爭者來說,獲得FDA核准不代表就可以高枕無憂。首先,輝瑞的abrocitinib可能會面臨更多障礙。FDA在對輝瑞的Xeljanz進行安全性調查後,已經對部分JAK抑制劑提出新的安全性警告。其他新藥前景— 如UCB的bimekizumab和羅氏的faricimab— 如果贏得FDA青睞,幾乎肯定會面臨激烈的競爭。
根據Evaluate的資訊,以下是2021年尚待審核結果、最有價值的新藥:
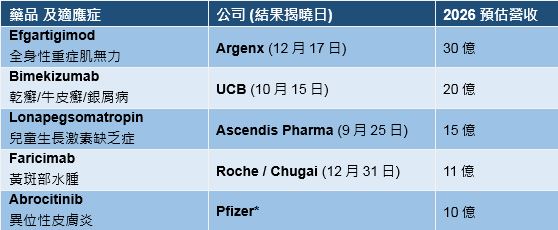
來源: Fierce Pharma, Evaluate Pharma by Randy Leonard. *安全性檢查延緩
公司: Argenx | 藥物: Efgartigimod
Argenx用於治療重症肌無力(gMG)的efgartigimod新藥在FDA審核名單中居首。重症肌無力是一種會導致肌肉功能喪失的自體免疫性疾病。該藥物的審核結果將在12月17日揭曉。
如果獲得核准,efgartigimod將成為第一個跨越FDA新藥終點線的FcRn抗體藥物。投資銀行SVB Leerink估計,到2030年,這類治療自體免疫性疾病的藥物銷售額可能達到250億美元。
Evaluate認為到2026,efgartigimod將為Argenx帶來30億美元的業績。這家比利時製藥公司猜測,面對一些重量級的FcRn競爭對手,如嬌生的Momenta Pharmaceuticals、UCB和AZ的Alexion Pharmaceuticals,該公司將有領先對手三年的機會。
Efgartigimod新藥會阻擋FcRn (新生兒Fc 受體),一種免疫球蛋白G(IgG)的保護受體。該方法被認為可以降低幾種自體免疫性疾病的致病性IgG抗體。
Efgartigimod公佈了有利的後期試驗資料,資料顯示,在26周後,efgartigimod對症狀的緩解遠勝於安慰劑,這是FcRn藥物第一個臨床三期成功的好消息,也代表FDA有望核准該藥物。
在服用efgartigimod、乙醯膽鹼受體抗體陽性的患者中,近68%對該藥物有反應,而服用安慰劑的患者只有29.7%。同時,56.8%的患者的藥物反應至少延續8周,12周時下降到34.1%。
Argenx還在努力推進efgartigimod用於其他五項適應症,並在歐洲和日本接受審查。
公司: UCB | 藥物: Bimekizumab
UCB的bimekizumab將面臨嚴峻的競爭。 這項用於治療乾癬(牛皮癬)單株抗體藥物的審核決定將在10月15日揭曉。
如獲核准,這種IL-17A和IL-17F雙特異性抑制劑可望上市,並證明它可以超越嬌生和諾華等重量級公司。據Evaluate估計,到2026年該藥物銷售有望達到20億美元。
在兩項獨立的後期研究中,UCB的bimekizumab在治療中重度乾癬病患者的表現,勝過嬌生的Stelara和諾華的Cosentyx。
根據該公司去年發表於《刺胳針》上的結果, 85%以bimekizumab治療的患者在16周時乾癬面積和嚴重程度改善達9成以上。59%患者皮膚以PASI 100指標來看回復為正常狀態。這項試驗的對照組為嬌生的藥物Stelara。
同時間Stelara組只在半數患者中、達9成回復正常水準。有了這些結果,分析師認為,如果bimekizumab能在與諾華Cosentyx的競爭中取得同樣成績,前景更加看好,而bimekizumab也確實做到了。
8月發表在《新英格蘭醫學雜誌》上的結果顯示,在16周後,bimekizumab改善了62%的患者皮膚,而Cosentyx近50%。然而bimekizumab的表現,與輕中度口腔念珠菌、或口腔中真菌較高的感染率有關。
UCB可能會在臨床之外面臨其他障礙。有人擔心,高度競爭的乾癬症領域,包括艾伯維的Skyrizi和Humira,禮來的Taltz和安進的Otezla,有可能以龐大的行銷預算來一較高下。更多競爭者、如必治妥施貴寶和輝瑞,也會影響UCB的新藥。
公司: Roche | 藥物: Faricimab
拜耳和Regeneron藉由眼藥Eylea安然度過新冠疫情風暴,甚至還成功地增加Eylea的市佔。
現在羅氏希望透過旗下新藥、針對濕性老年性黃斑變性(AMD)和糖尿病黃斑水腫(DME)的faricimab,來扭轉局面。FDA預計在今年底前會做出決定。
瑞士大廠羅氏的新藥faricimab,臨床上至少與去年世界第六大暢銷藥物媲美。羅氏在四項三期試驗中發現,這種針對血管內皮生長因子和Ang2的雙特異性抗體的表現並不比Eylea差,儘管大多數患者的服藥時間間隔更長。
試驗過程中,約有一半的患者能夠持續使用faricimab四個月,相較使用Eylea則是兩個月。由於Eylea是玻璃體內注射給藥,可能為會為羅氏帶來該公司亟需的優勢。
但這可能不足以撼動Regeneron的領先地位。Evaluate認為faricimab到2026年的銷售額為11億美元,遠遠低於Eylea目前的銷售額。
公司: Pfizer | 藥物: Abrocitinib
FDA終於結束了對輝瑞新藥Xeljanz長達數月的安全性調查,這類JAK抑制劑,包括另一款異位性皮膚炎藥物abrocitinib,將出現在FDA審核決定的名單上。
但abrocitinib安全性調查的不利結果已對JAK類藥物產生影響,abrocitinib表現如何到現在還沒有定論。FDA最近對Xeljanz、艾伯維的Rinvoq和禮來的Olumiant發出了新的心臟疾病和癌症警告,一些分析師預期abrocitinib也可能會有類似的警告。
Evaluate估計,abrocitinib到2026年銷售將達到10億美元。這營收數字只有輝瑞自家預測的三分之一。
主管機關過去曾因安全性問題否決其他JAK抑制劑,特別是Gilead用於類風濕性關節炎的藥物filgotinib。至於調查結果是否會阻礙abrocitinib上市,輝瑞和FDA都沒有表示。
儘管如此,abrocitinib在通往FDA最終決策的跑道上仍取得部分勝利。8月底,輝瑞表示,旗下口服藥abrocitinib在第2和第4周消除患者的瘙癢和濕疹症狀時,優於賽諾菲和Regeneron的Dupixent,雖然安全性相關的關鍵細節仍未可知。
來源: From Pfizer to Argenx: A look at potential blockbusters awaiting FDA decisions this year

